Блютанг и блютангоподобные болезни
В.В.Макаров,
доктор биологических наук, профессор; Российский университет дружбы народов, Москва, e-mail: vvm-39@mail.ru;
В.А.Мищенко,
доктор ветеринарных наук, профессор; Федеральный центр охраны здоровья животных (ФГБУ «ВНИИЗЖ»), г. Владимир;
О.И.Сухарев
доктор ветеринарных наук, г. Москва.
РЕЗЮМЕ
Возникновение и распространение трансмиссивных экзотических трансграничных и блютангоподобных инфекций на неэндемичных территориях отражает современный этап эволюции инфекционной патологии и представляет актуальную проблему в эпизоотологии и эпидемиологии. Основными причинами явления служат объективные изменения в эписистемах «хозяин-вектор-патоген-среда», обусловленные природно-климатическими факторами. Общие паразитосистемные особенности зкзотических инфекций в условиях распространения определяют трудность их контроля.
БЛЮТАН Г (КАТАРАЛЬНАЯ ЛИХОРАДКА ОВЕЦ)
Инфекция жвачных животных многих видов, клинически протекающая в форме воспалительно-некротических поражений лицевой части, катарального воспаления желудочно-кишечного тракта и коронитов. 24 серо-типа возбудителя имеют самостоятельные ареалы циркуляции. В паразитарной эписистеме основным хозяином является крупный рогатый скот и некоторые экзотические жвачные, переносящие инфекцию в основном бессимптомно и поддерживающие ее естественную энзоотическую циркуляцию в природных и иных очагах. Овцы поражаются болезнью в тяжелой острой манифестной форме как индикаторы эпизоотического процесса без вирусоносительства, летальность достигает 10% (рис.1) .
Глобальный нозоареал блютанга до начала 21 в. располагался широкой периэкваториальной полосой в зоне, ограниченной с севера и юга 40° и 35° соответствующей широты. Вирус присутствует везде, где есть Culicoides spp. - его биологические переносчики (Африка, Америка, Австралия, многие страны Южной Азии и Океании) (рис. 2); из 1250 их видов 30 обладают векторной компетентностью в разной степени. Однако инфекция в клинически выраженной форме стационарно наблюдается только в отдельных странах (США, некоторые африканские страны).
В последние годы 20 в. нозоареал блютанга существенно расширил-ся за счет стран южной Европы вдоль 40-й параллели, находящихся в достаточной географической близости к энзоотичным регионам африканского севера (табл. 1, рис.3). Здесь произошли крупные эпизоотии

Рис. 1. Стереотип паразитарной системы блютанга в природе - циркуляция вируса среди крупного рогатого скота (1) и тупиковая инфекция у овец (2)
и вспышки болезни, причиной которых могли служить периодические заносы инфекции с инфицированными переносчиками, распространяющимися через средиземноморское пространство потоками ветров или иными способами. Определенно: именно таким путем из Алжира или Туниса, расположенных на расстоянии 350 км, инфекция была занесена на о. Сардинию. Нельзя исключать, что блютанг на юге Европы также приобретает характер энзоотии. С 1998 по 2006 гг. пять серотипов вируса были изолированы в 12 странах, где эпизоотии блютанга сопровождались гибелью миллионов овец и КРС. В частности, на юге Италии, где возбудителем являлся высокопатогенный экзотический вирус 1 серотипа, вызывающий тяжелое заболевание с высокой летальностью, в 2001 г. погибли 500 тысяч овец, в 2003 г. - 200 тысяч (рис.4).

Рис. 2. Глобальный нозоареал блютанга - переносчики Culicoides spp. и серотипы вируса
Летом 2006 года блютанг, вызванный вирусом 8 серотипа, неожиданно возник и распространился в несвойственном регионе - северо-западной Европе. В течение нескольких недель эпизоотия охватила пограничную зону между Бельгией, Нидерландами, Германией, Люксембургом, Францией радиусом 200 км. Если общая заболеваемость в Европе в том году составила 1262 вспышек, то 1254 в их числе - в северо-западном регионе. Вирус успешно «перезимовал», и до осени 2007 года на северо-западе Европы пораженными реэмерджентной эпизоотией оказались 40000 пунктов, где содержались восприимчивые животные. Далее последовали «реимпортированные» случаи уже индигенного происхождения (Великобритания, Дания, Швеция, Норвегия, Швейцария, Польша, Чехия), в 2009 году заболеваемость в северном направлении достигла 60-й параллели (рис.5).
Необычно широкая территориальная экспансия инфекции в Европе в двух альтернативных направлениях (юг и северо-запад) очевидно произошла вследствие глобальных преобразований климата, сопрово-ждающихся повышением температуры и влажности на континенте в параллельных направлениях - факторами, благоприятствующими жизни членистоногих и Culicoides в частности. Десятилетие, последовавшее с 1998 года, на которое пришлась европейская экспансия блютанга, характеризовалось самыми высокими температурными показателями за последние пятьдесят лет, прогрессивно возрастающими до 2007 года
Табл. 1. Возникновение и распространение блютанга в Европе на рубеже 20-21 веков
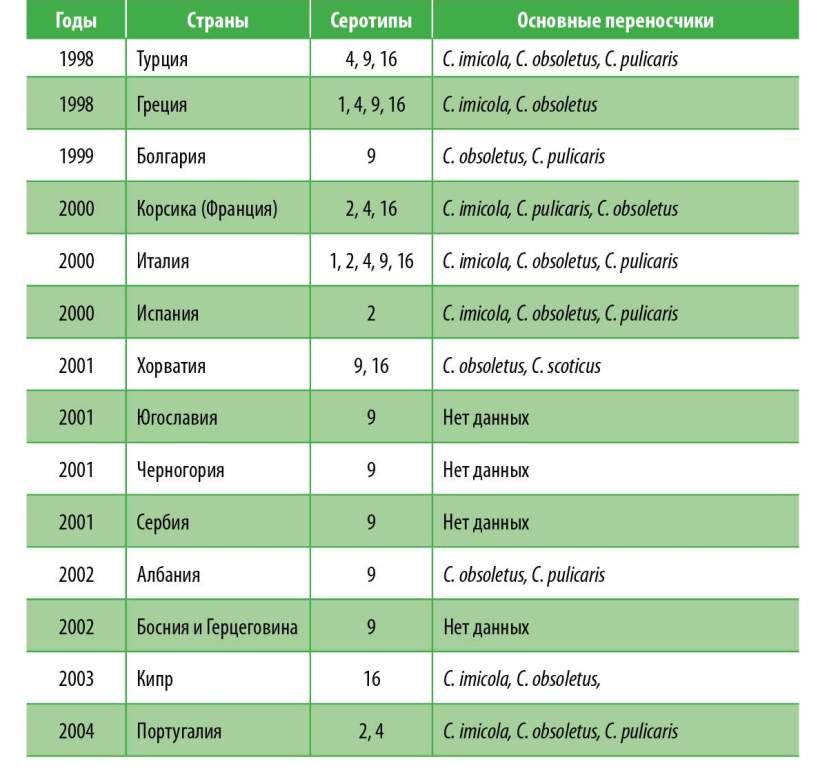

Рис. 3. Четыре пути заноса блютанга наюг(1 -3) и северо-запад (4) Европы и серотиповая эпизоотология вируса [12]

Рис. 4. Массовая гибель овец в эпизоотияхна юге Европы
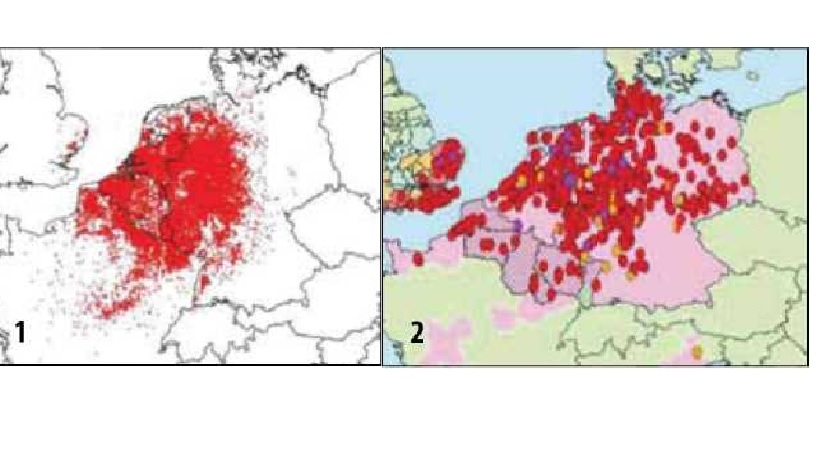

Рис. 5. Территориальное возникновение и распространение блютанга в 2007 году (1) и болезни Шмалленберга в 2011 году (2) на старте эпизоотии на северо-западе Европы, дальнейшая регистрация распространения вируса Шмалленберга (заболеваемость, серопозитивность, инфицированность переносчиков) в Западной Европе в первом квартале 2012 года (3)
[Известно, что векторная трансмиссия блютанга начинается при среднесуточной температуре > 15° и существенно возрастает с ее повышением на каждый градус]
Это привело к приобретению векторной компе-тентности (восприимчивости) индигенных, палеар-ктических групп Culicoides spp., в частности, дополнительно к С. imicola (основного глобального вектора блютанга) двух представителей - С. obsoletus sensu stricto и С. pulicaris (см. таблицу 1 и рисунок 2). [Аналогичное явление имело место в США в 2004 году, когда в связи со сходными климатическими изменениями в штате Луизиана появились новые BeKTopbi-Cu//co/des.] Первичная инфекция вирусом 8 серотипа могла быть занесена в регион инфицированными переносчиками воздушным или морским транспортом, возрастающими популяциями и оборотом восприимчивых зоопар-ковых экзотов (буйволы, олени, зебры, хищные кошачьи), или иным путем.
ЭПИЗООТИЧЕСКАЯ ГЕМОРРАГИЧЕСКАЯ БОЛЕЗНЬ ОЛЕНЕЙ (ЭГБО)
Известна в США и Канаде с 1890 года с такими син-дромальными названиями, как «черная нога», «черный язык», микотический стоматит, геморрагическая септицемия, и т.п. Нозологическая самостоятельность ЭГБО была оформлена только в 1955 году. Это острая, нередко фатальная инфекция животных семейства Cervidae и других диких жвачных многих видов, прежде всего высоколетальная (до 90%) для белохвостых оленей (Odocoileus virginianus), и, реже, блютангоподобная болезнь КРС. В последнем случае клинические признаки разной степени выраженности: лихорадка, анорексия, дисфагия, изъязвление и некротические поражения слизистой рта, гиперемия и отеки конъюнктивы, язвы на морде, гиперемия сосков и вымени, экстенсивные геморрагии, дегидратация, хромота .
Возбудитель ЭГБО таксономически и иммунологи-чески близок к вирусу блютанга. В числе его восьми или более серотипов серотип 2 представляет вирус-возбудитель отдельной нозологической формы - болезни Ибараки. Передается мокрецами рода Culicoides, активность которых в течение года - от круглогодичной в тропических странах до периода август-октябрь на севере США и в Канаде - определяет внутригодо-вую динамику и сезонность инцидентности. Особен-ностями векторной трансмиссии являются продолжительные вирусемия (до 50 дней) и внешний инкубационный период (10-14 дней). Для эпизоотологии болезни также характерны стереотипные 8-10-летние циклы, обусловленные природными или погодными флюктуациями популяционной и иной активности переносчиков-векторов.
Как и вирус блютанга, вирус ЭГБО вне обязательной связи с заболеваемостью в мире выделяется повсеместно, где существуют ареалы мокрецов (см. рис. 3), включая Северную Америку, Африку, Азию, Австралию, Японию. Однако систематические эпизоотии с высокой инцидентностью до последнего времени возникали среди оленей разных видов только в Западном полушарии - на севере США и юге Канады; в частности, эпизоотия, распространившаяся в 2010 году в юго-западных штатах Канады, сопровождалась гибелью более 1000 оленей.
Однако недавно возникли эмерджентные эпизоотические вспышки ЭГБО среди КРС в четырех странах Старого Света - по всему южному периметру Средиземноморского региона [Марокко, Алжир, Израиль (2006), Турция (2007)] с весьма серьезными клиническими проявлениями и последствиями. В связи с этим в 2008 году болезнь включена в Список МЭБ как опасная инфекция, подлежащая нотификации.
БОЛЕЗНЬ ИБАРАКИ
Блютангоподобная трансмиссивная инфекция крупного рогатого скота, протекающая с клиническими признаками, сходными с таковыми у этих животных при блютанге и ЭГБО (некоторые авторы считают болезнь синонимом ЭГБО у крупного рогатого скота). Вирус (серотип 2 из серогруппы орбивируса ЭГБО) с 1959 года вызывает экстенсивные вспышки и эпизоотии в Японии и распространяется в тропическом регионе Дальнего Востока, в частности, в Корее и на Тайване. Серопозитивные животные обнаруживаются в Австралии и Индонезии [5,7].
БОЛЕЗНЬ АКАБАНЕ
Возбудитель впервые идентифицирован в 1959 году в Японии. Поражает беременных коров, овцематок и коз, патогенетической мишенью служат плоды. Переносится мокрецами рода Culicoides, которые эффективно распространяют инфекцию с лета до зимы, в том числе на большие расстояния потоками ветров. Эпизоотически и клинически болезнь протекает в виде многочисленных массовых конгенитальных пороков (мальформации) у телят, а также ягнят и козлят. Рождение сильно деформированных животных с уродливыми конечностями, изменениями мозга, вплоть до отсутствия, редко сопровождается их выживанием.
По аналогии с блютангом, большинство телок инфицируются до первой беременности, и их иммунитет защищает плод от внутриутробного заражения; инфекция развивается только при отсутствии у беременных коров достаточного уровня нейтрализующих антител. При заражении интактных беременных животных вирус размножается и персистирует в трофобластах плацентарных котиледонов и последовательно инва-зирует плод, поражает быстро размножающиеся клетки, преимущественно нервной системы и скелетных мышц, вызывая некротизирующий энцефаломиелит и полимиозит. Если плод не погибает, у него существенно нарушается органогенез со структурными последствиями и развивается синдром мальформации - артрогриппоз, гидранэнцефалия, порэнцефа-лия, микрорэнцефалия, гидроцефалия.
Болезнь распространена в виде вспышек и эпизоотии в Японии, Австралии, Малайзии и на Индийском субконтиненте. Вероятно, что инфекция присутствует в Южной Америке. Есть очевидные свидетельства присутствия возбудителя на Среднем Востоке (Кипр, Израиль, Турция), где в 1969-1970 гг. произошли крупные эпизоотические вспышки с поражением сотен голов крупного и мелкого рогатого скота. Этим подтверждается вероятность периэкваториального распространения инфекции по аналогии с блютангом и ЭГБО, т.е. везде, где существуют Culicoides. Клиническая же форма инфекции - спорадические вспышки артрогриппо-за и гидранэнцефалии телят, ягнят, козлят - регистрируется только в двух крупных регионах мира - Южной Азии (от Японии до Австралии) и Среднем Востоке (до Южной Африки) .
Очевидно, что болезнь Акабане по объективным признакам имеет все перспективы распространения в новых неэндемичных ареалах, таких как южная Европа .
БОЛЕЗНЬ ШМАЛЛЕНБЕРГА
В ноябре 2011 года на северо-западе Европы (в Германии, Нидерландах и Бельгии) возникла эмерджент-ная эпизоотия новой, неизвестной ранее инфекционной болезни, которая сопровождалась врожденными пороками развития плодов и мертворождаемостью у крупного рогатого скота, овец и коз. Инфекция получила топонимическое название по месту первичной регистрации. В первом квартале 2012 года заболеваемость регистрировалась уже на большой территории восьми западноевропейских стран (табл. 2, рис. 5).
Как следует из рис. 5, ее возникновение и распространение эпизоотологически абсолютно совпали с признаками экспансии северо-запада Европы вирусом блютанга (нозогеография, восприимчивые животные, сезонность) пятью годами раньше. Практически несомненна была трансмиссия новой инфекции с участием аналогичного вектора - мокрецов Culicoides spp. Учитывая установленные сроки, динамику развития конгенитальной инфекции и тератогенеза по аналогии с блютангом у овец, болезнью Акабане у крупного и мелкого рогатого скота, первичное заражение животных также могло быть отнесено на конец лета и осень 2011 года. В этот период наивысшей активности вектора там же отмечено массовое острое переболевание дойных коров с угнетением, отказом от корма, повышенной температурой (40° и выше), снижением продуктивности, иногда диареей, без вовлечения овец, завершившееся в октябре. В пораженных стадах заболеваемость составила 20-70% в течение нескольких недель. К ноябрю про-явилась полная клиническая картина патологии воспроизводства, преимущественно среди овец, - аборты, преждевременные роды, рождение мертвого и нежизнеспособного потомства,тератогенные эффекты мальформации (трясущаяся шея, аномальная кривизна спины, контрактура конечностей-артрогрипоз, гидроцефалия, гипоплазия головного мозга, тортикол-лис, деформация челюстей, атаксия, асциты грудной и брюшной полостей, параличи, слепота, отеки подкожной клетчатки). В различных случаях количество
Табл. 2. Зарегистрированная заболеваемость болезнью Шмалленберга на конец марта 2012 года
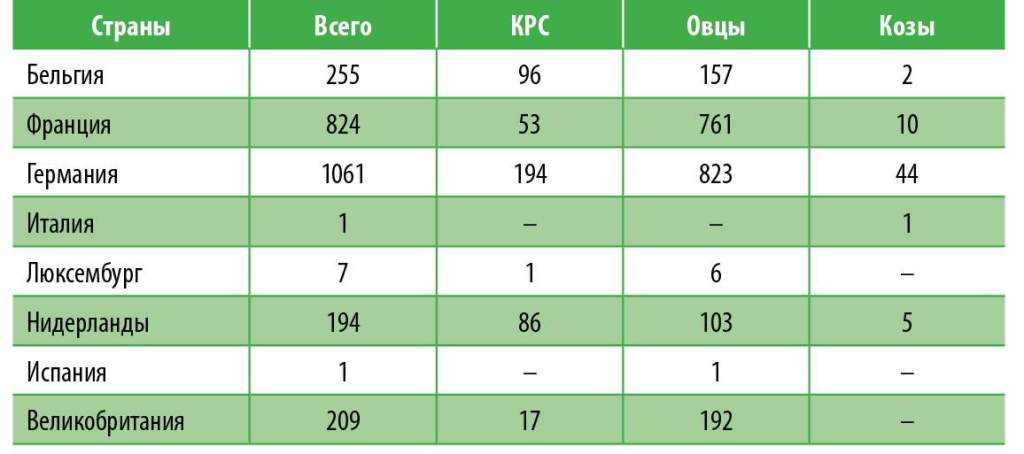

Рис. 6. Вирус Шмалленберга - морфология (1)и тонкий срез (2) [фото FLI]
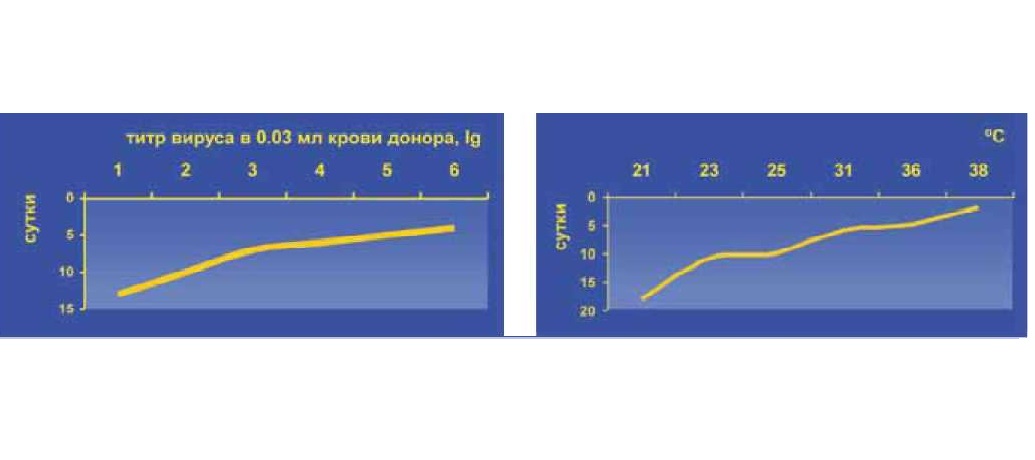
Рис. 7. Зависимость продолжительности внешнего инкубационного периода трансмиссии арбовирусов от уровня вирусеми и инфицированного донора (1)и температуры среды (2)
врожденных уродств составляло от 20 до 50% . Таким образом, вероятный инфекционный цикл был аналогичен таковому при болезни Акабане - первичное заражение интактных беременных животных, их первичное острое переболевание, затем поражение потомства. Соактанты-хозяева в паразитарной системе нового заболевания не выяснены.
Возбудителем болезни Шмалленберга оказался новый вирус, получивший аналогичное название, отнесенный к роду ортобуньявирусов семейства Bunyaviridae - наиболее представительной категории арбовирусов (рис. б). Происхождение вируса Шмалленберга может иметь объяснение в способности сегментированного генома буньявирусов к реассортации по аналогии с вирусами гриппа; именно таким путем возник в Перу новый ортобуньявирус «Икитос», вызвавший недавнюю вспышку новой болезни. Вероятное реассортационное происхождение вируса Шмал-ленберга также объясняет тройственную гомологию по трем различным сегментам его генома с другими тремя членами ортобуньявирусов серогруппы Сим-бу - вирусами Акабане, Айно и Шамонда (соответственно по L-, S- и М-сегментам генома). Поскольку вирусы группы Симбу ранее натерритории Европы не регистрировались, вирус Шмалленберга по отношению к данной эмерджентной ситуации имеет очевидно эк-зотическое происхождение.
ЗАКЛЮЧЕНИЕ
1. Как следует из приведенной фактологии, очевидная эволюция трансмиссивных экзотических зоонозов в третьем тысячелетии может иметь чрезвычайные последствия на фоне известных успехов в контроле инфекционной заболеваемости эпизоотическими контагиозными болезнями. Эмерджентность долго дремавших в центрах происхождения и природных очагах опасных патогенов с катастрофическим потенциалом, ранее пренебрежительно сегрегируемых как «тропические», не является случайным феноменом. Даже приблизительное рассмотрение дает возможность выявить целый ряд общих и частных особенностей вызываемых ими заболеваний и возникающих ситуаций, объясняющих распространение за пределы традиционных нозоа реалов.
Безусловно, наиболее общие причины - текущая эра глобализации и изменения климата. Температура среды и потепление - ведущие факторы восприимчивости и компетенции вектора, делающие умеренные условия Палеарктики приемлемыми для возникновения, распространения, циркуляции, «перезимовывания» некогда строго природно-очаговых возбудителей, приуроченных к тропической экологии. Параметры среды, определяющие активность членистоногих переносчиков, предполагают ее градуальное увеличение с ростом температуры и влажности, что сопровождается аналогичным линейным ростом эффективности трансмиссии возбудителей инфекций (см. рис. 7) и, как следствие, активизации паразитарных эписистем.
2. Рассмотренные десять наиболее важных трансмиссивных экзотических вирозов не исчерпывают список потенциально опасных инфекций с вероятной эмерджентностью и угрозой экспансии новых территорий. Прежде всего, это касается десятков «пренебрегаемых» явлений инфекционной патологии, эпизоотическая и эпидемическая значимость которых не осознана в достаточной степени. В их числе нозологически определенные болезни овец Вессельсброна и Найроби - острые лихорадочные зоонозные инфекции с диареей, абортами и иными тератогенными эффектами. Особый интерес представляет потенциал ортобуньявирусов, насчитывающих около 170 представителей; относящаяся к ним упоминаемая выше серогруппа Симбу включает не менее 25 вирусов.
Большинство из них патогенны в естественных условиях для рогатого скота и трансмиссивны, их переносчиками во всех случаях служат те же кровососущие комары, мокрецы, москиты родов Culicoides, Aedes,Anopheles, Coquillettidia, Culiseta, распространенные повсеместно (в мировой фауне более 3000 видов, в Палеарктике обитают 202 вида, в фауне России найдены 106 видов). Условия, благоприятствующие вспышкам тератогенных инфекций, - наличие восприимчивых животных в стадии беременности и увеличение популяционной плотности вектора.
3. Тератогенез как весьма тяжелый и необратимый патогенетический феномен, видимо, вообще присущ экзотическим арбовирусам, в частности, представителям семейства Bunyaviridae и особенно ортобуньявирусам, многие их которых вызывают синдром врожденных уродств: вирус долины Кэш (Cache Valley) оказался этиологически связанным с эпизоотией неонатальной патологии и мальформации ягнят в США в 1987 году, с широко распространенной серопревалентностью среди лошадей, домашних и диких жвачных; потенциально патогенны вирусы Айно, Питон, Дуглас, Тинару.
4. Очевидно, что блютангоподобные болезни целесообразно выделять в оригинальную группу не только на основе клинического сходства, стереотипности их паразитарных эписистем, трансмиссии мокрецами рода Culicoides, эмерджентной зависимости от изменений факторов экологического (природно-климатического) порядка и других эпизоотологически рациональных характеристик. Еще один важный объединяющий признак - вероятная общность патогенеза с наблюдаемой закономерной последовательностью этапов (стадий) развития патологических процессов и явлений в направлении «заражение интактных самок домашних жвачных в ранней стадии беременности -> первичная острая инфекция, от бессимптомной до лихорадочной с различными экстенсивными симптомами —» трансплацентарная инфекция плодов —» тератогенный эффект, проявляющийся мальформацией через З-б месяцев».
5. Стереотип паразитарных эписистем рассмотренных инфекций - трехчленных замкнутых, преимущественно сложных, нередко с неопределенным резервуарным хозяином в конкретных и новых нозоа-реалах, их природная очаговость, сезонная и многолетняя цикличная динамика вектора, неоднозначная полипатогенность - все это исключает возможность их контроля радикальными мерами, по аналогии с эпизоотическими контагиозными заболеваниями при условии становления эндемии. На новых территориях последнее происходит относительно быстро, с односезонным «инкубационным периодом» энзоотии, и очевидная массовая заболеваемость - уже свидетельство укоренения, исходя из примеров с блютан-гоподобными инфекциями.
При таких условиях единственно возможный способ контроля - поголовная защита домашних животных путем систематической вакцинации и поддержание их популяционной невосприимчивости, как это принято вскоре после возникновения и укоренения блютанга в странах северо-запада Европы. Эта a priori паллиативная мера означает признание неблагополучия последних на перспективу с надеждой на эрадикацию эндемии за счет креационизма. Такое вполне возможно, т.к. в патогенетическом стереотипе заболеваний данной группы, по крайней мере, тератогенный компонент может со временем «отрегулироваться» естественным путем за счет невосприимчивости беременных самок домашних жвачных, переболевающих в раннем возрасте, до беременности, и приобретающих постинфекционный иммунитет, защищающий плод.
То же, по-видимому, будет касаться и болезни Шмалленберга.
Тем не менее, согласно этому опыту важно, что показаниями к применению массовой вакцинации должно служить только начало фактически регистрируемой клинической заболеваемости, как это успешно использовано в своевременной ликвидации первичных вспышек АЧЛ в Испании. Попытки вакцинации против блютанга на интактных, благополучных территориях, предпринятые в РФ при установлении казуистической серопозитивности в отсутствие вируса, лишены противоэпизоотического смысла, однако при продолжении они могут иметь контрпродуктивный эффект, создавая условия для проэпизоотичивания.