Терапия коров с фолликулярными кистами яичников овулином
Евгения Сергеевна Седлецкая, аспирантка
кафедры зоогигиены, акушерства и ветеринарии
Георгий Петрович Дюльгер, д.в.н., зав.
кафедрой зоогигиены, акушерства и ветеринарии
ФГOУ ВПО «Российский государственный аграрный университет - Московская сельскохозяйственная академия имени К.А. Тимирязева, www.vetclinic.timacard.ru.
Проведена клинико-эхографическая оценка терапевтической эффективности Овулина, нового отечественного препарата хорионического гонадотропина при фолликулярных кистах яичников у коров. Препарат водили однократно или двукратно (при отсутствии эффекта от ранее проведенной гормонотерапии) внутримышечно в дозе 3000 ЕД. По доле выздоровевших животных эффективность гормонотерапии составила 100%, оплодотворившихся – 72,73%.
Кисты яичников – достаточно распространенная причина бесплодия у коров. По современным представлениям, они возникают из-за несвоевременной и/или недостаточной для овуляции секреции лютеинизирующего гормона (ЛГ) в период половой охоты. Ановуляция с трансформацией преовуляторного фолликула в кисту яичника приводит к удлинению межотельного периода, нарушению ритма воспроизводства и экономическим потерям.
Для кист яичников свойственен транзиторный характер существования. По наличию/отсутствию пристеночной лютеиновой ткани кисты делят на лютеиновые и фолликулярные. При образовании лютеиновой кисты (так же как и при овуляторном половом цикле), отмечают транзиторное повышение концентрации прогестерона в крови. В отличие от фолликулярных кист яичников, их стенка частично или на всем протяжении выслана слоем лютеиновой ткани толщиной до 1…5 мм. По своему строению она не отличается от таковой у желтых тел полового цикла и проходит те же стадии развития: образования, расцвета и регрессии. При трансформации преовуляторного фолликула в фолликулярную кисту выпадает лютеиновая фаза полового цикла: концентрация прогестерона в крови не превышает 1 нг/мл. На ранних стадиях кистогенеза фолликулярные кисты яичников, также как и преовуляторные фолликулы, продуцируют повышенные количества эстрогенных гормонов. Однако с возрастом в результате дегенерации клеток гранулезы и фиброза их стенки (иногда с явлениями микролютеинизации) они становятся гормонально неактивными.
При утрате функциональной активности кисты яичников подвергаются обратному развитию и заменяются новой доминантной структурой яичника, которая либо овулирует (феномен самовыздоровления) либо трансформируется в новую кисту (феномен смены одной кисты на другую). Лютеиновые кисты имеют более благоприятный прогноз, чем фолликулярные [3, 4].
Частота спонтанного восстановления половой функции при этой патологии достигает 21,7…78,6% [4, 11, 12, 15, 16, 22].
По мнению большинства исследователей, при кистозной болезни яичников лучше придерживаться активной лечебной тактики, чем рассчитывать на самовыздоровление [4, 9, 15, 22]. По нашим наблюдениям [Шипилов В.С., Дюльгер Г.П., 1990] тактика выжидания приводит к развитию практически у каждой третьей кистозной коровы хронической формы болезни со сменой одной кисты на другую.
В последние годы в ветеринарном акушерстве и гинекологии у крупных домашних животных, и в частности коров, все большее применение имеет трансректальная визуальная эхография.
Ультразвуковые исследования существенно улучшают диагностику кистозной патологии яичников, дают возможность проводить дифференцированную гормонотерапию коров с фолликулярными и лютеиновыми кистами и по реакции яичников уже на 5-10 день от начала лечения оценивать эффективность ее проведения [4].
В настоящее время из всего многообразия гормональных средств, предложенных для терапии кистозной патологии яичников у коров, наибольшее применение имеют препараты гонадотропин-рилизинг гормона (ГнРГ), человеческого хорионического гонадотропина (чХГ) и простагландина Ф-2 альфа (ПгФ2?). При дифференцированном подходе к лечению они признаны методом выбора: препараты ГнРГ и чХГ - при фолликулярных кистах яичников, ПгФ2? – при лютеиновых [25].
ХГч является первым выделенным из мочи беременных женщин плацентарным гонадотропином. По биологическим и иммунологическим свойствам он близок к ЛГ гипофиза. Коммерческие препараты ХГ получают из мочи беременных женщин. Технология получения гонадотропинов из мочи человека разработана в 60-х годах прошлого столетия. Она стала традиционной и используется и в настоящее время. Для экстракции человеческого хорионического гонадотропина, как правило, используют мочу беременных женщин в первом триместре беременности.
Для лечения коров с кистами яичников препараты ХГч стали применять с середины 50-х годов прошлого столетия. С лечебной целью ХГч применяли внутривенно в дозе 2500-6000 МЕ [1, 2, 5, 8, 19, 20, 23, 26, 27], внутримышечно в дозе 4000-10000 МЕ [6, 10, 17, 23, 24], реже внутрикистозно в дозе 500-2500 МЕ [10, 17, 23] или внутриперитонеально в дозе 5000-6000 МЕ [17]. Выздоровление отмечено у 60,0…90,0%, а оплодотворение – у 40,0…88,0% животных. После успешного применения ХГч в яичниках кистозных коров отмечают овуляцию крупных пузырчатых фолликулов и/или лютеинизацию стенки кист, транзиторное повышение концентрации прогестерона в крови. Продолжительность периода от начала лечения до первой стадии возбуждения полового цикла колебалась от 19,7 до 24,0 дней, а от начала лечения до оплодотворения – от 29,0 до 91,0 дня.
Показано, что применение ХГч позволяет улучшить показатель восстановления плодовитости у коров с кистами яичников на 27,1% по сравнению с раздавливание кист яичников через стенку прямой кишки (Kudlac E. et al., 1970) и на 33,0% по сравнению с плацебо-терапией (Stolla R. et al., 1980).
Анализ данных литературы [4, 8, 14, 19, 21, 24, 26] свидетельствует, что ГнРГ и ХГ обладают примерно одинаковой терапевтической эффективностью. В последние сорок лет они заняли ведущее место в лечении бесплодия коров, обусловленного кистами яичников. После применения ГнРГ и ХГч у некоторых коров с кистами яичников (по различным материалам, от 6,5 до 40,0%) половая функция не восстанавливается. Причина этого явления еще не совсем ясна.
Цель исследования: дать клиническую и клинико-эхографическую оценку терапевтической эффективности Овулина у коров при фолликулярных кистах яичников.
Овулин является первым зарегистрированным отечественным препаратом человеческого хорионического гонадотропина для ветеринарного применения. Препарат производится ФГУП «Московский эндокринный завод» по заказу фирмы ЗАО «ВетИмпэкс». По химической структуре и механизму действия он идентичен, а по стоимости одной лечебной дозы намного дешевле импортных ветеринарных препаратов ХГч (Фоллютеин, Хорулон, Гонамон и др.). Выпускается во флаконах по 5 мл, содержащих 1000 ЕД стерильного лиофилизированного порошка хорионического гонадотропина (в комплекте с растворителем). Препарат рекомендуется использовать для стимуляции овуляции и коррекции функциональной деятельности гонад коров, кобыл и собак. При кистозной патологии яичников препарат рекомендуется применять коровам внутримышечно в дозе 3000 ЕД.
Исследования выполнены в ЗАО Агрофирма «Подмосковное» Московской области на 20 высокопродуктивных коровах черно-пестрой породы с одиночными или множественными фолликулярными кистами яичников.
Кисты яичников у коров диагностировали по данным двукратного клинико-эхографического исследования яичников бесплодных коров с перерывом 7 дней. При ультразвуковом обследовании гонад бесплодных коров за кисты яичников принимали тонкостенные жидкостные образования с анэхогенным содержимым размером более 20 мм при отсутствии при первом и втором исследовании желтого тела. О морфотипе кисты судили по наличию/отсутствию пристеночной лютеиновой ткани.
После эхографического уточнения диагноза поголовье коров с фолликулярными кистами яичников разделили на опытную (n=11) и контрольную (n=9) группы. Животным опытной группы для стимуляции овуляции применяли однократно или двукратно (при отсутствии эффекта от ранее проведенной гормонотерапии) овулин, внутримышечно в дозе 3000 ЕД, контрольной группы – препарат не водили.
Условия кормления подопытных коров были аналогичными. При круглогодовом стойловом содержании коровам ежедневно утром или вечером в течение примерно 2 ч предоставляли моцион на выгульной площадке.
Осеменяли коров в выявленную по признакам течки и полового возбуждения стадию возбуждения полового цикла искусственно, двукратно - спермой, замороженной в форме пайетт. Активность спермы после оттаивания составляла не менее 4 баллов.
Восстановление овариальной функции и наступление беременности контролировали с помощью УЗИ.
Полученный цифровой материал подвергнут статистической обработке. Оценку достоверности различий по P<0,05 проводили с применением t критерия Стьюдента для абсолютных парных величин. Результаты представлены средними величинами и их стандартными ошибками как M±m.
1. Особенности репродуктивного и акушерского анамнеза и параметры кистогенеза у коров с фолликулярными кистами яичников
|
Показатели |
Группа |
|
|
Опытная |
Контрольная |
|
|
Количество коров |
11 |
9 |
|
Количество лактаций |
2,09±0,30 |
1,89± 0,25 |
|
Удой за 305 дней последней законченной лактации, кг |
8651,38±554,4771 |
8594,22±389,49 |
|
Продолжительность бесплодного периода, дней |
68,82 ± 14,11 |
75,33±24,20 |
|
% коров с осложненным акушерским
анамнезом |
63,64 |
66,67 |
|
Среднее количество кистозных фолликулов на корову |
1,27±0,13 |
1,22±0,14 |
|
Размеры кистозных фолликулов, мм |
27,00±1,75 |
29,36±3,11 |
2. Эффективность восстановления половой функции и плодовитости у подопытных коров с фолликулярными кистами яичников
|
Показатели |
Группа |
|
|
опытная |
контрольная |
|
|
Количество коров, n (%) |
11 (100) |
9 (100) |
|
Отмечено восстановление овариальной
функции (овуляции), n (%) |
11 (100) |
8 (55,56) |
|
Сроки осеменения, дн |
22,14 ±6,71 |
23,91±3,97 |
|
Частота наступления беременности, n (%) |
8 (72,73) |
4 (44,44) |
|
Сроки наступления беременности, дн |
31,88± 5,94 |
15,75±5,56 |
|
Индекс осеменения |
1,25±0,15 |
1,25±0,23 |
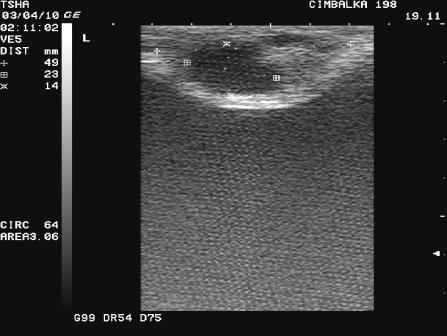
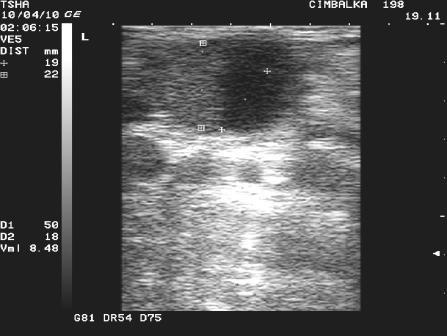
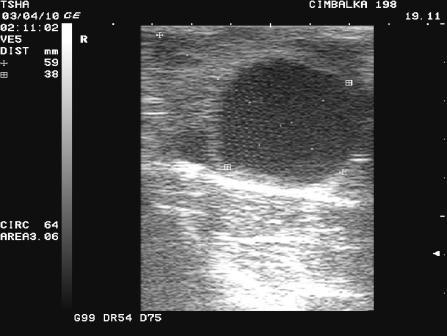
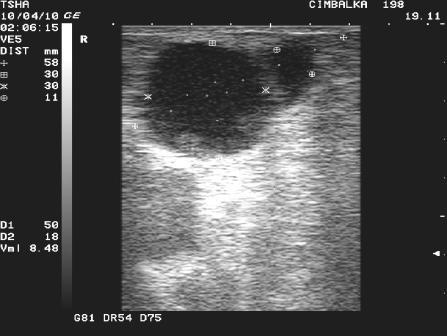
Рис.1. Особенности положительной реакции яичников на овулин у коровы Цымбалка 198 с одиночной фолликулярной кистой правого яичника. При первом УЗИ (день 0): в левом яичнике визуализируется крупный фолликул размером 23х14 мм, в правом – фолликулярная киста размером 38 мм с пузырчатым фолликулом диаметром примерно11 мм. При втором УЗИ (день 8): в левом яичнике крупный пузырчатый фолликул в сочетании с желтым телом размером соответственно 19 и 22 мм, в правом – фолликулярная киста 30х30 мм в сочетании с пузырчатым фолликулом 11 мм. Корова пришла в охоту и была плодотворно осеменена на 16 день от начала лечения.
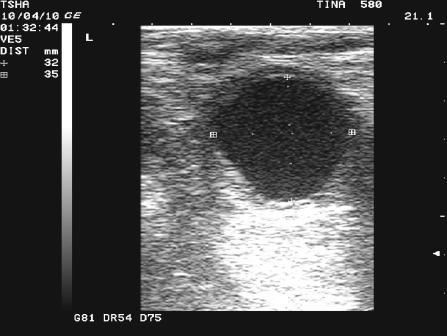
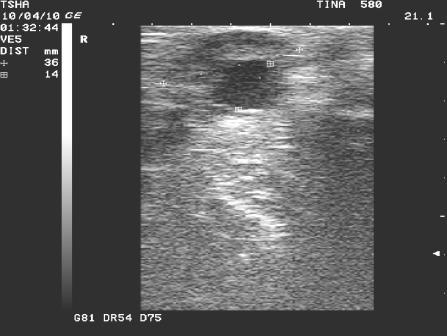
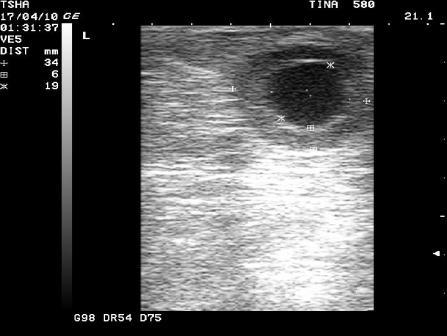
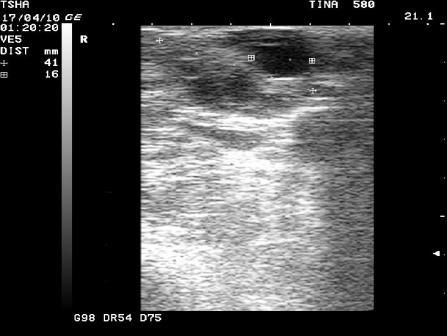
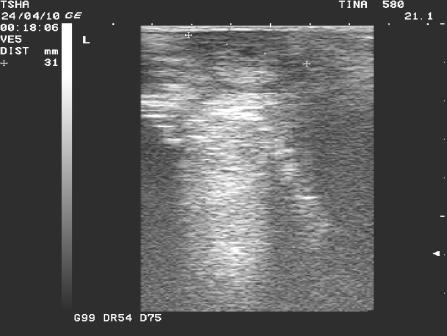
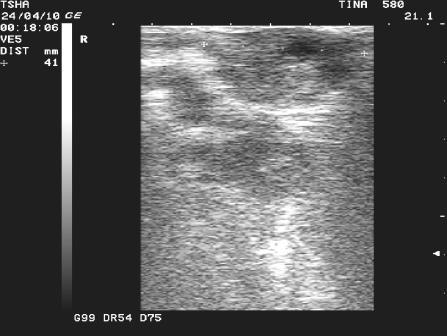
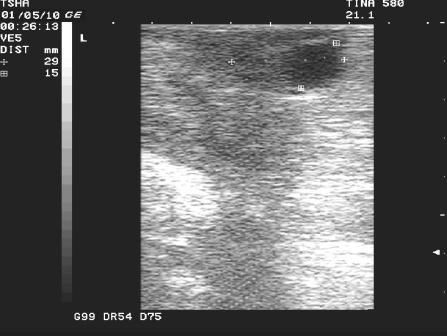
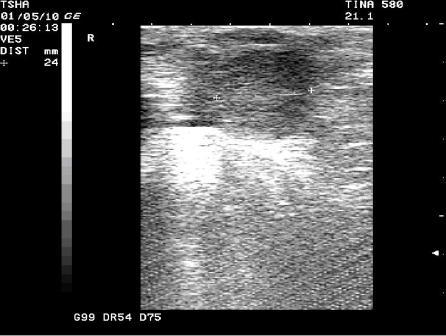
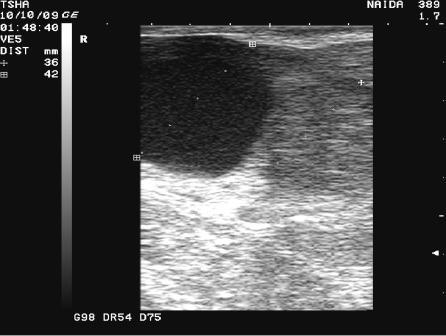
Рис. 2. Особенности положительной реакции на лечение у коровы Тина 580 с крупной фолликулярной кистой левого яичника. Восстановление половой функции наступило после лютеинизации стенки кисты и ее регрессии. Корова пришла в охоту и плодотворно осеменена на 11 день после применения овулина.
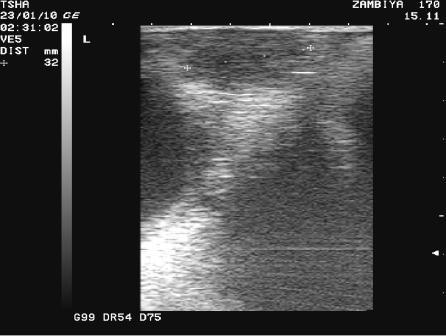
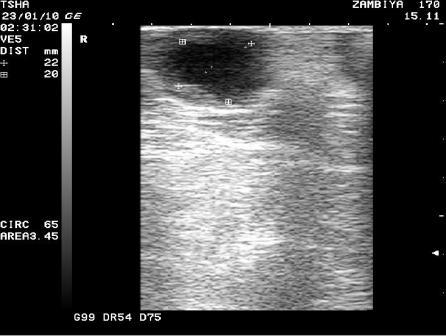
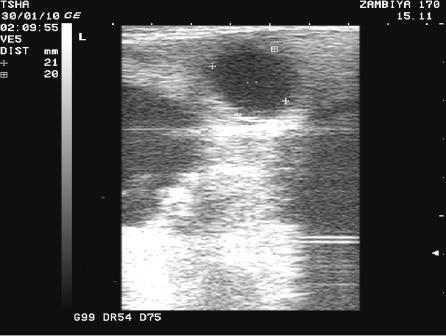
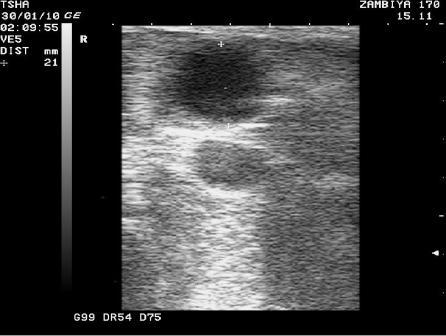
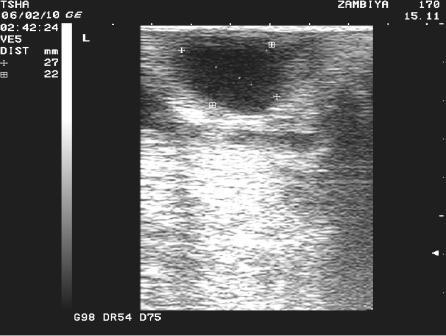
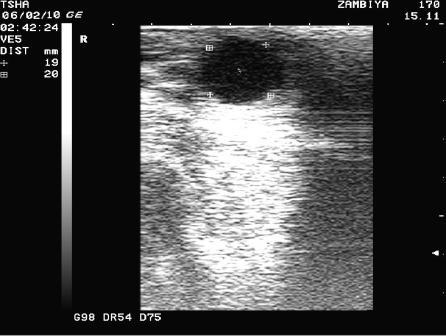
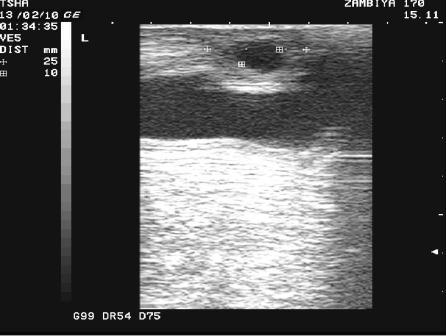
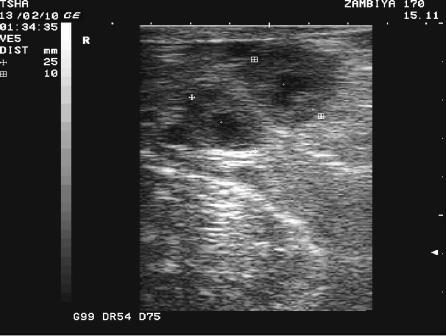
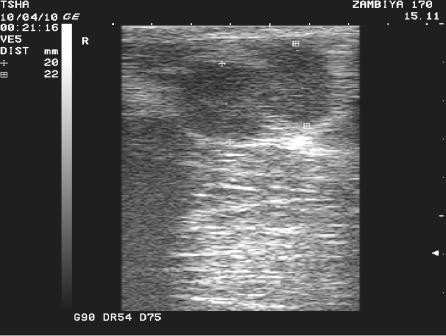
Рис. 3. Особенности восстановления овариальной функции у коровы Замбия 170 с фолликулярной кистой правого яичника. Овулин вводили 23.01.10 и 6.02.10. После первой гормональной обработки зафиксировали формирование фолликулярной кисты де ново в левом яичнике, после второй - формирование двух кистозных желтых тел в правом яичнике. Корова плодотворно осеменена в на 46 день от начала лечения (32 день после второй гормональной обработки).
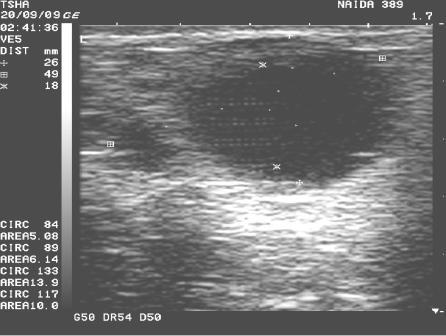
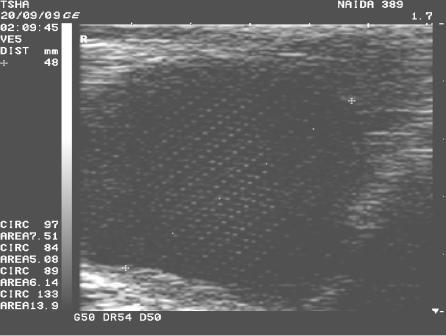
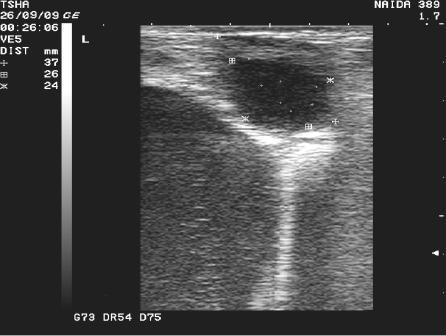
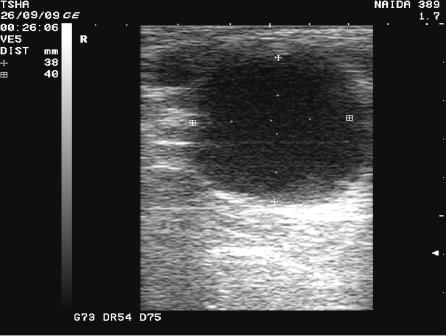
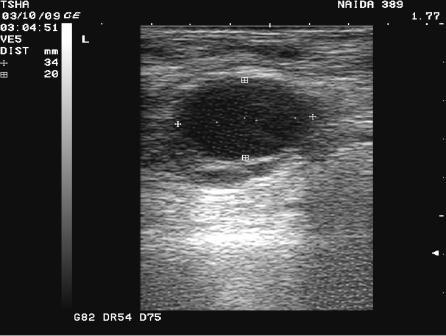
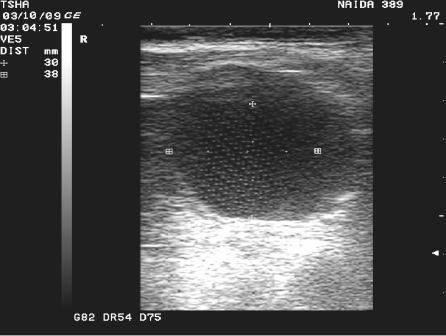
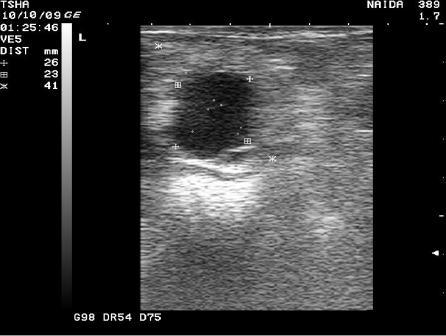
Рис.4. Спонтанное восстановление половой функции у коровы Найда 389 с крупными фолликулярными кистами в правом и левом яичниках. На 9 день наблюдения корова пришла в охоту и плодотворно осеменена. В правом яичнике отметили образование крупного желтого тела диаметром 38 мм. Регрессия кист, особенно со стороны правого яичника, происходила медленно. К 21 дню наблюдения ее диаметр уменьшился в диаметре с 48 до 42 мм
Животные опытной и контрольной групп существенно не отличались по количеству лактаций, уровню молочной продуктивности, продолжительности бесплодного периода, характеру течения последней беременности, родового и послеродового периодов и параметрам кистогенеза (таб.1).
За 60 дней наблюдения в опытной группе у всех коров зафиксировали восстановление половой функции (табл.2). У абсолютного большинства из них (10, или 90,91%) восстановление овуляции отметили после первого курса гормонотерапии, у одной (9,09%) – второго.
При положительной реакции на лечение на 7-й день после введения овулина у 9-ти или 81,8% коров регистрировали формирование желтого тела солидного или кистозного типа в одном случае (9,1%) – образование двух желтых тел (рис.3), в другом – лютеинизацию стенки кисты с последующей ее регрессией и восстановлением овуляции.
Варианты положительного овариального ответа на овулин проиллюстрированы на рис.1 и 2.
Эхографическими признаками отрицательного овариального ответа служили: отсутствие желтого тела (маркера произошедшей овуляции) и формирование кисты вновь.
Пример отрицательного овариального ответа на овулин после первого курса гормонотерапии и восстановления овуляции после его повторного применения у коровы Замбия 170 проиллюстрирован на рис. 3.
За тот же период времени в контрольной группе спонтанное восстановление овуляции отметили у 5, или 55,6% (рис.4), коров, развитие хронической формы кистозной болезни яичников (со сменой одной кисты на другую) - у 3, или 33,33%, животных. У одной коровы (Римлянка 132) после спонтанной регрессии кисты наблюдали признаки депрессии фолликулогенеза (гипофункция яичников).
Первое осеменение коров опытной и контрольной групп было проведено практически в одни и те же сроки - на 22,14±6,71 и 23,91±3,97 дни от начала опыта соответственно.
После осеменения в один или несколько половых циклов в опытной группе оплодотворилось на 28,29% больше животных, чем в контрольной группе. По сравнению с животными контрольной группы беременность наступала через более продолжительное время от начала опыта (на 16,13 дня), но при одинаковом количестве осеменений на оплодотворение.
При диагностике стельности у большинства животных (11-ти, или 91,65%) отмечали моноовуляцию с развитием одноплодной беременности, у одной (8,35%) – формирование в яичниках двух желтых тел и развитие двойни (рис.5).
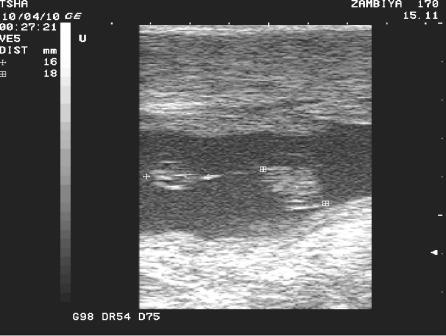
Рис.5. Эхографические признаки многоплодной беременности у коровы Замбия 170. При сканировании внутренних половых органов коровы на 38 день после осеменения в правом яичнике отметили развитие 2 желтых тел, в ипсилатеральном роге – двух эмбрионов размером 16 и 18 мм соответственно.
Таким образом, полученные нами данные однозначно свидетельствуют о высокой терапевтической эффективности овулина при его дифференцированном однократном или двукратном применении коровам с фолликулярными кистами яичников под Уз-контролем. По доле выздоровевших животных эффективность метода составляет 100%, оплодотворившихся – 72,73%. По сравнению с выздоровлением без лечения эти показатели улучшаются соответственно на 44,44 и 28,29% .
Результаты наших исследований позволяют рекомендовать для дифференцированной гормонотерапии коров с фолликулярными кистами под динамическим клиническим или клинико-эхографическим контролем использовать отечественный ветеринарный препарат хорионического гонадотропина овулин внутримышечно однократно или двукратно (при отсутствии эффекта от ранее проведенной терапии) в дозе 3000 ЕД.
Литература
1. Горячев В.С., Прокофьев М.И., Плишина К.И.// Бюл. ВНИИ физиологии, биохимии и питания с.-х. животных. - 1982. - Вып.2.
2. Дюльгер Г.П.// Ветеринария - 1992. - N.4. - С.49 - 50.
3. Дюльгер Г.П., Нежданов А.Г.// Сельскохозяйственная биология - 2006. - N.6. - C.62-67.
4. Дюльгер Г.П. Кистозная патология яичников у коров: Монография. М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева, 2010.
5. Ключников Г.А.// Зоотехнические основы повышения продуктивности животных на Дальнем Востоке. – Новосибирск, 1986.
6. Турков В.Г. Гипофизарно-гонадальные взаимоотношения у коров с кистами яичников и разработка метода гормональной терапии: Автореф. дис. … канд. вет. наук. – Воронеж, 1984.
7. Шипилов В.С., Дюльгер Г.П.// Ветеринария - 1990. - N.4.
8. Alanko M., Katila T.// Nord. Vet. – 1980. – Vol.32. – N.3/4.
9. Bartolome J.A., Thatcher W.W., Melendez P. et al. // J. Anim. Vet. Med. Assn. – 2005. – Vol.227. – N.9.
10. Berger G. // Vet.-Med. – 1985. – Jg.40. – N.1.
11. Carroll D.J., Pierson R.A., Hauser E.R. et al.// Theriogenology. –1990. - Vol. 34. - N.2.
12. Cook D.L., Smith G.A., Parfet J.R. et al.// J. Reprod. Fertil. - 1990. – Vol.90. – N.1.
13. Elmore R.E., Bierschwal C.J., Garverick H.A. et al.// Vet. Med. Small Anim. Clinician. – 1975. – Vol.71. – N.11.
14. Garverick H.A. Kesler D.J., Cantley T.C. et al.// Theriogenology. – 1976. – Vol. 6. – N.4.
15. Garverick H.A. // J. Dairy Sci. – 1997. – Vol.80. – N.5.
16. Hamilton S.A. Garverick H.A., Kesler D.H. et al.// Biol. Reprod. – 1995. – Vol.53. – N.4.
17. Heidrich H.J., Feibiger K. // Berl. Munch. Tierarztl. Wschr. – 1970. – Jg.83. – N.11.
18. Elmore R.E., Bierschwal C.J., Garverick H.A. et al.// Vet. Med. Small Anim. Clinician. – 1975. – Vol.71. – N.11.
19. Koppinen J., Vessanen H., Alanko M. // Nord. Veter. –Med. – 1984. – Vol.36. – N.1/2.
20. Kudluc E., Vrtel M., Minak M. // Dt. Tierarztl. Wschr. – 1970. – Jg.77. – N.2.
21. Nessan G.K., King G.J., McKay G.W. et al.// Canad. Vet. J. – 1977. – Vol.18. – N.2.
22. Peter A.T. // Reprod. Dom. Anim. – 2004. – Vol.39.
23. Roberts S.J. // J. Am. Vet. Med. Assn. – 1957. – Vol.131. – N.11.
24. Sequin D.E., Convey E.M., Oxender W.D. // Am. J. Vet. Res. – 1976. – Vol.37. – N.2.
25. Sprecher D.J., Strelow L.W., Nebel R.L. // Theriogenology. – 1990. – Vol. 34. – N.6.
26. Stolla R., Bostedt H., Wend H. und W. Leidl // Berl. Munch. Tierarztl. Wschr. – 1980. – Jg. 93. – N.1.
27. Zuchner L., Busch W., Bach S. et al.// Mh. Vet.-Med. – 1981. – Jg.36. – N. 1.