Российская академия сельскохозяйственных наук
ГНУ Всероссийский научно-исследовательский
институт животноводства
МАТЕРИАЛЫ РОССИЙСКОЙ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА IN VITRO
Для участия в конкурсе «За инновационные разработки в области сельскохозяйственных наук» в рамках выставки «Золотая осень-2010»
Автор: Сингина Г.Н.
Соисполнители: Тарадайник Т.Е., Тарадайник Н.П., Гладырь Е.А.
Введение
Технология экстракорпорального созревания ооцитов и культивирования эмбрионов является надежным и экономичным источником зародышей разных стадий развития и неотъемлемой частью биотехнологий будущего, направленных на решение широкого спектра задач фундаментального и прикладного значения. Во всем мире данный экспериментальный подход рассматривается как один из надежных и эффективных способов разведения высокопродуктивных и ценных особей, а также способ сохранения генетического потенциала редких и исчезающих пород. Создание трансгенных животных с измененным обменом веществ в направлении повышения качества и эффективности продукции, а также животных генетически устойчивых к ряду инфекционных заболеваний не возможно без надежного источника ооцитов и эмбрионов различных стадий развития.
Межвидовое осеменение и клонирование может быть использовано для сохранения и разведения, исчезающих и редких видов животных, или тех животных, которые находятся в не зоны искусственного разведения.
В силу доступности, дешевизны и относительно короткого периода использования, выращенные вне организма (in vitro) половые клетки и эмбрионы являются наиболее предпочтительными объектами для исследований в области биологии развития коров, а также других видов животных, в частности человека.
В мировой практике технология экстракорпорального получения зародышей крупного рогатого скота является рутинной и успешно используется биотехнологическими компаниями в работах по трансплантации эмбрионов, клонированию и получению трансгенных животных.
В нашей стране лишь незначительное количество исследователей занималось данной проблемой в рамках выполнения собственных научных работ.
С 2006 года в лаборатории экспериментальной эмбриологии центра биотехнологии и молекулярной диагностики ВИЖ проводилась работа по отработке и усовершенствованию способ созревания, оплодотворения ооцитов и культивирования эмбрионов крупного рогатого скота in vitro. На основании полученных данных разработана технология экстракорпорального получения зародышей у данного вида сельскохозяйственных животных, эффективность, которой, соответствует международному уровню и подтверждена рождением живого потомства после трансплантации животным-реципиентам.
Описание технологии.
Технология получения эмбрионов крупного рогатого скота включает в себя несколько этапов (Рис 1).
Рис.1.
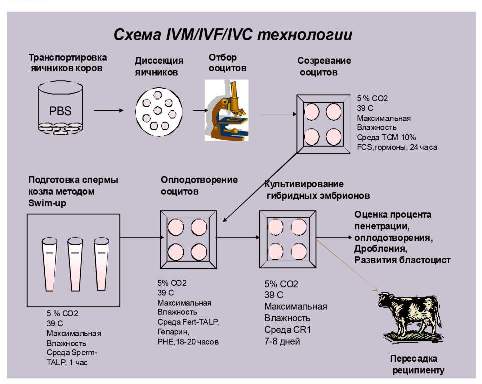
Исходным материалом служат яичники коров после их убоя, которые транспортируются в лабораторию в течение 1- 9 часов в физиологическом растворе с антибиотиками. В стерильных условиях яичники подвергаются диссекции с целью вскрытия антральных фолликулов и выделения ооцит кумулюсных комплексов. Полученные таким образом женские половые клетки, многократно промываются и помещаются в 4-х луночные чашки Петри со средой созревания, покрытой равным слоем легкого минерального масла (Рис.2). Через 24 часа культивирования ооциты перенесятся в среду оплодотворения.
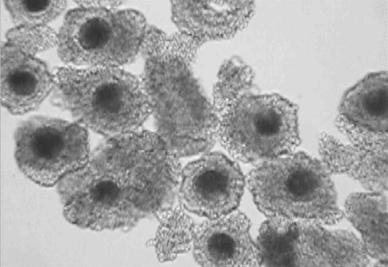
Рис.2. Ооциты-кумулюсные комплексы коров перед постановкой на созревание (ЮОхув).
Оплодотворение проводится заморожено-оттаянным семенем. С целью подготовки спермы к оплодотворению одна - две соломинки с замороженной спермой быка размораживается в водяной бане при 37° С в течение 12 секунд. После чего содержимое соломинок переносится в пробирки со средой для капацитации и помещается в инкубатор на 50 минут. По истечению данного периода из пробирок отбирается верхних 750 мкл супернатанта с последующим его разбавлением свежей средой и центрифугированием при 500 g в течение 7 минут. Полученный после центрифугирования осадок добавляется к ооцитам, так чтобы конечная концентрация была 1.5 х 10б сперматозоидов на мл (Рис.3).
Рис.3. Ооцит-кумулюсные комплексы коров во время оплодотворения in vitro (200хув.).
Через 18-20 часов соинкубации осторожным пипетированием ооциты отмываются от сперматозоидов и клеток кумулюса в среде Talp-HEPES и переносятся в модифицированную среду CR1. В данной среде предполагаемые зиготы культивируются до стадии бластоцисты в течение 7-8 дней.
Получение и выделение ооцитов проводится в среде ТСМ 199 содержащей 25 мМ HEPES , 0,1 % PVA. Для созревания ооцитов используется мод. среда ТСМ 199 (Gibco), с добавлением, 10% FCS и гонадоторопных гормонов (FSH, LH) Капацитация спермы происходит в среде Talp (модифицированный раствор Tyrode's, содержащего 6 мг/ мл BSA, 10 мМ натрий лактата и 1.25 мМ Na-пирувата). Среда оплодотворения также является модифицированным раствором Tyrode\ с добавлением 10 мкг/ мл гепарина, 20 |JM пенициллинамина, 10 |JM гипотаурина и 1 |JM эпинефрина.
Созревание, оплодотворение и культивирование происходит в условиях инкубатора при 39°С и 5% СО2 в воздухе (Рис. 4).
Рис. 4. Созревание и оплодотворение ооцитов коров и культивирования гибридных клеток в инкубаторе при 5 % СО2 в воздухе.
Оценка эффективности технологии.
Оценку эффективности технологии и качества полученных эмбрионов проводили по следующим показателям:
1. Проценту ооцитов коров пенетрированных сперматозоидами.
Данный показатель определяется методом визуальной оценки зоны пеллюцида, перевителлинового пространства и цитоплазматической мембраны ооцита на присутствие в них целых или только головок сперматозоидов. В данном случае анализ проводится на нативных ооцитах на инвертированном микроскопе при увеличении 400-600 раз (Рис. 5).
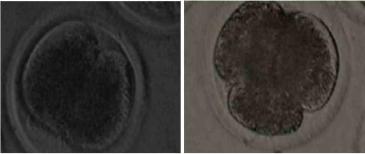
Рис 5. Ооциты с различными формами проникновения сперматозоидов через 24 часа с момента начала процедуры оплодотворения (400хув.).
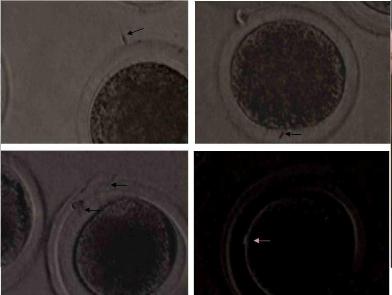
2. Проценту оплодотворения.
Норму оплодотворения определяли в нативных ооцитах по образованию второго направительного тельца (Рис.5) и в суховоздушных препаратах по анализу образования пронуклеусов. (Рис.6).
Норму оплодотворения определяли в нативных ооцитах по образованию второго направительного тельца (Рис.5) и в суховоздушных препаратах по анализу образования пронуклеусов. (Рис.6).
Рис. 5 Ооциты с НТ (400хув.) Рис.6. Пронуклеусы (бООхув.)
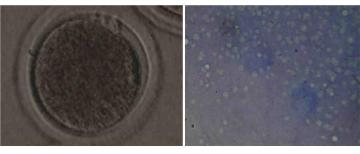
3. Проценту дробления.
Процент дробления определяли по количеству эмбрионов на стадии двух бластомеров (Рис. 7а)
1. Динамике развития (Рис. 7b-d) Рис.7. Развитие эмбрионов крупного рогатого скота (4 ООХ увеличение)
а) 2-х клеточный эмбрион b) 4-х клеточный эмбрион
с) 8-ми клеточный эмбрион d) ранняя морула
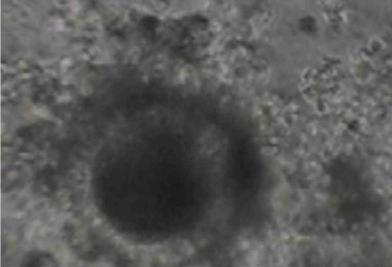
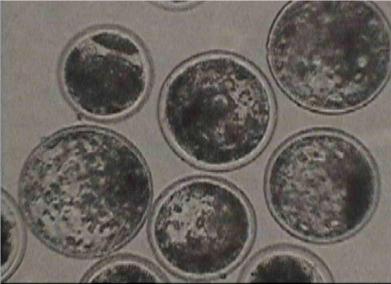
2. Проценту образования бластоцист (Рис. 8).
Рис.8. Бластоцисты крупного рогатого скота, полученные in vitro
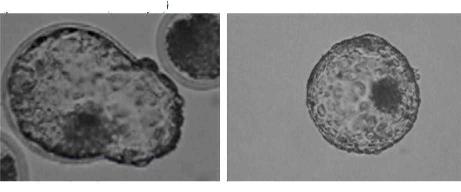
3. Проценту вылупления бластоцист, который является одним из важных показателей полноценности полученных эмбрионов (Рис. 9 а,Ь)
Рис.9. Процесс вылупления бластоцист крупного рогатого скота, полученных in vitro (200х. ув.,)
а) вылупляющаяся бластоциста b) вылупившаяся бластоциста
4. Проценту приживляемости эмбрионов и рождению живого потомства.
Приживляемость эмбрионов определяли по фактической стельности, через 2 месяца после осеменения животных методом ректальной ультразвуковой диагностики.
Показатели эффективности технологии.
Анализ эффективности показал, что при оплодотворении ооцитов коров in vitro норма пенетрации их сперматозоидами и норма оплодотворения составляет в среднем 95 % и 78 % соответственно. 64.87 % поставленных на созревание ооцит-кумулюсных комплексов после оплодотворения проходят первое деление дробления, из которых в среднем 38 % (до 52 %) достигает стадии бластоцисты. Анализ полноценности полученных бластоцист методом дополнительного культивирования в течение 9-10 дней показал, что полученные бластоцисты вылупляются в среднем в 67 % случаев.
11 из полученных in vitro эмбрионов крупного рогатого скота были пересажены животным-реципиентам (3 в 2009 году и 8 в 2010). По результатам ректальной ультразвуковой диагностики приживляемость эмбрионов составила 63,64 %. Из трех животных с пересадкой в 2009 году одна корова отелила телочку (Рис. 10). Процент рождения живого потомства составил 33.3 %. В России это первый теленок полученный методом экстракорпорального оплодотворения in vitro ооцитов выделенных яичников коров (Рис. 11).
Рис.10. Телята, рожденные после пересадки полученного in vitro эмбриона корове-реципиенту (ВИТРА) и методом искусственного осеменения (ВИВА).
Рис. 11. Процедура диссекции яичников и отбора ооцитов
а) диссекция b) отбор и селекция ооцитов